格拉斯哥研究人员利用细菌负载微凝胶探索干细胞工程
格拉斯哥大学的研究人员正在将他们的研究扩展到生物打印领域,他们的研究成果在最近发表的《细菌负载微凝胶作为干细胞工程的自主3D环境》中进行了概述。该团队开发了一个微流体系统,由一个允许干细胞和基因工程的非致病细菌包含在海藻酸钠微凝胶中。

虽然大多数技术依赖于液滴挤出,但研究人员正在通过一步液滴微流体方法创建更高效的系统。珍珠花边微凝胶的制备是在生理酸碱度下进行的,没有任何护套材料,通道尺寸和总体设计意味着避免细胞上的剪切应力并促进活力。
研究人员表示,“制作的凝胶结构是独特的,它具有单个微胶囊中的区室化单元以及纤维结构中的连通性。还注意到,分隔的微管和连接它们的链路是高度可调的,从而产生高度单分散的珍珠花边互连结构。”
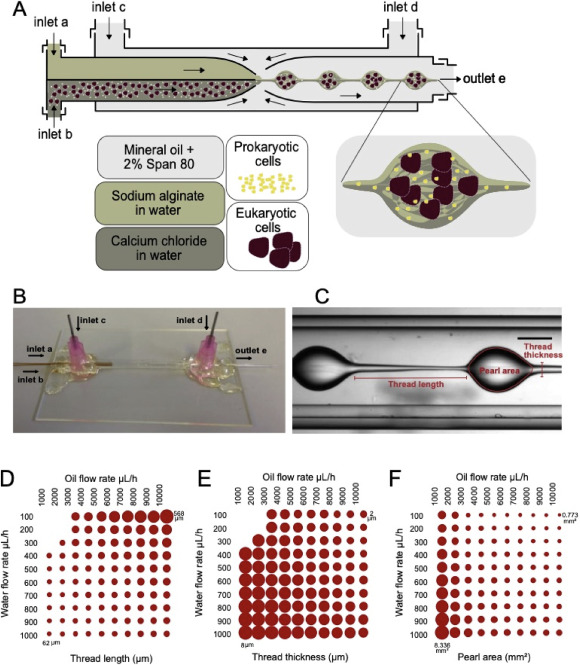
基于液滴的微流体设置。(A)微流体装置的示意图和原核细胞和真核细胞的封装。(B)基于毛细管的微流体装置的图像。(C)微流体装置中珍珠形成的快照,其中指示用于量化组装的珍珠的参数。(D)具有相应流速的螺纹厚度图(Y轴:水流;X轴:油流)。(E)螺纹厚度图。(F)珍珠面积图。
在这个项目中,研究人员创建了一个“体外3D模型”,用于研究真核细胞(骨髓间充质干细胞,hbm-msc)和原核细胞(工程化非致病细菌乳球菌,乳杆菌)之间的共生关系。
虽然细菌在生物打印中通常被用作蛋白质的“生产有机体”,但它们也可以作为指导细胞生长和分化的机制。研究人员还使用了抑菌抗生素磺胺甲恶唑来防止有害细菌的生长。
制作了四种3D打印形状,包括直线、三角形、正方形和圆形,排列如下:
•线 - 两个圆盘(180度角)
•三个三角形(内角为60度)
•四个正方形(内角90度)
•八个圆形(135度内角,八角形)
微流体系统使研究人员能够创建“单分散”结构,适用于药理学筛选、生物学研究和个性化医学等应用。

载有细胞的海藻酸盐构建体的扫描电镜图像。海藻酸钠微凝胶与基底介质中的MSC的相位对比图像(A);海藻酸钠微凝胶与成骨介质中的MSC的相位对比图像(B);海藻酸钠微凝胶与含有两个乳杆菌菌落的MSC的相位对比图像(C),它们以组成型方式表达FNIII 7-10或BMP-2。样品在培养两周后固定。比例尺:100μm。扫描电镜图像显示,海藻酸盐与MSC在基底介质中形成的结构,在海藻酸盐结构(D)的横截面上有细胞印记;海藻酸盐与MSC形成的微凝胶和两个乳杆菌菌落过度填充空间(E);海藻酸盐与MSC形成的微凝胶在成骨基质中形成。圆形实体覆盖细胞、空腔和精细膜状结构(F)。与水凝胶在水介质中的状态相比,水凝胶稍微脱水/收缩。
珍珠花边水凝胶的连通性可以提供一种梯度研究的方法,在这种方法中,每种类型的细胞的数量和相对密度可以被控制。研究人员总结说:“它还可用于时间序列索引研究,并为本研究所展示的低成本、易于制造的3D生物打印原型提供一种手段。”
本研究中的微凝胶已被用作概念验证,用于建模一个可调平台,在该平台中,作为ECM的水凝胶以及生长因子的生产和释放都可以以低成本和高精度时空控制进行设计。这是一个试图进一步设计体外系统的更多方面,为研究细胞及其与可调节的动态ECM样环境的相互作用和更大的控制铺平了道路。这是一个很好的选择。
随着生物打印技术在全球研究中的不断进步,科学家们创造了新的生物打印墨水、3D打印微表面、渐进式微流体技术等等。
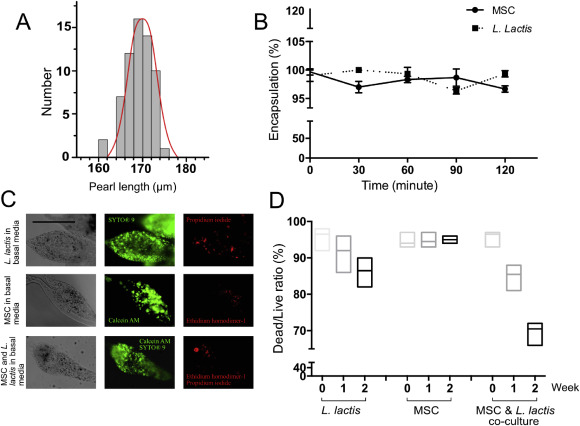
微珠的单分散性、包封性和活性。(A)两种可混溶流体流在层流条件下产生的水凝胶的珠径(长轴)分布,两种内相的流速为500 μl h-1 ,外相的流速为5000 μl h-1。分析每种情况下的n≥5–10微凝胶。形成的珍珠平均长度为167μm,相对标准偏差为3.2%。比例尺:100μm(B)细胞(MSC和乳酸乳杆菌)通过形成的水凝胶封装效率。每个时间点的细胞计数是在室温下连续2小时以30分钟的间隔进行8次测量的结果。(C)含乳酸乳杆菌和MSC的两周龄海藻酸钠水凝胶的荧光图像。水凝胶用乳酸杆菌杆菌活菌试剂盒和MSC活菌/细胞毒性试剂盒染色。两种试剂盒都将活细胞染色为绿色 (SYTO® 9 and Calcein AM) 和非活细胞染色为红色(碘化丙啶和同二聚乙胺-1),将50:50的试剂盒混合物用于共培养。比例尺:100μm。(D)乳酸乳杆菌、MSC和共培养的生存力图。













