匹兹堡大学:3D打印乳腺研究癌前病变

最近,匹兹堡大学的Adrian V. Lee为美国陆军医学研究和装备司令部编写了一项关于3D打印医学模型和乳腺癌研究的研究。他的研究结果在国防技术信息中心出版的“用于研究癌前病变的3D生物打印模型”中进行了概述。
假设体外3D生物打印的癌前期乳腺细胞模型可以帮助识别低风险恶变前疾病的标记物,研究小组最终由以下专家组成,他们致力于3D打印乳腺:
•外科肿瘤学家
•乳腺生物学家
•生物医学工程师
•癌症生物学家
为研究的每一年指定了目标,完成如下:
•第1年 - 量化乳腺发育,发现应变依赖性差异。
•第2年 - 继续描述乳腺的发育特征。
•第3年 - 研究体外乳腺细胞的生长模式。
图2:遗传背景影响整个乳腺导管几何形状。从E-钙粘蛋白染色的乳腺整体支架制备3D重建。在出生后第17天从11种不同自交系的雌性中收集组织。显示的是(A)总管道长度,(B)平均管道长度,(C)总分支数,(D)分支密度,(E)导管直径,(F)曲率,(G)分叉角和(H) 二面角。每个框表示3至7只动物的数据。统计显著性设定为a = 0.05。箱子按应变中位数排序。具有相似上标的框与Tukey的HSD相似(P> 0.05)。
小鼠在研究中也被广泛使用,其年龄对应于人类青春期的发病,并且乳腺尚未受到发情的影响。通过育种配对,研究人员能够使用乳房组织进行3D成像,然后将其送到匹兹堡大学进行3D打印。
“这项工作代表了不同遗传背景的近交系小鼠导管结构和模式的第一次3D比较。”Lee表示,“这项研究的假设是导管模式,以及在出生后早期发育过程中实施的典型分支行为与遗传背景不同。”
研究小组注意到了以下方面的差异:
•管道总长度
•平均管道长度
•分支总数
•分支密度
•导管段直径
•曲率
随着研究的进展,研究人员开始直接用I型胶原蛋白和其他ECM蛋白水凝胶进行生物打印:
“我们开发的乳腺导管模型代表了一个世界上第一级的复杂性,它是由一个生物打印机和多个ECM和水凝胶组成。”
在下一阶段,研究人员使用祖细胞来3D打印乳腺导管结构。除此之外,他们还完成了对3D祖细胞的进一步成像和评估(仍在进行中)。
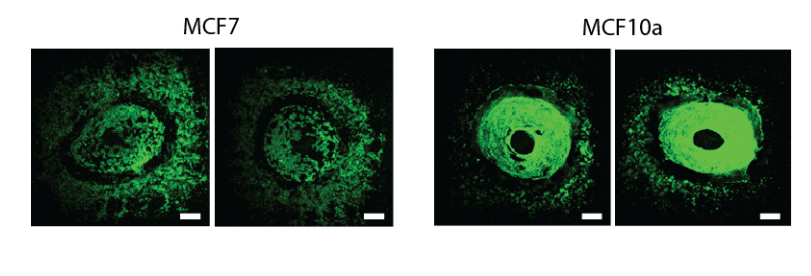
图3:在接种和培养一周的构建体中,胶原的分层是一致的。左侧显示的构建体用MCF7细胞培养,左侧的构建体用MCF10a细胞培养。在所有构建体中,在胶原蛋白的顶部边缘周围可见细胞间隙,表明胶原蛋白原本在那里,但在细胞的作用下被拉开。不然,我们将在顶侧藻酸盐的所有区域上看到细胞散布在边缘的周围。比例尺为1毫米。
他们注意到模型中的结构丢失,因为细胞开始不利地影响胶原蛋白,因此挑战产生了。所有生物打印结构都经历了分层,无论它们具有何种类型的细胞基础。生长被中断,整体表征被“抑制”。他们重新设计了结构,以便在整体研究中实现更好的生长和质量。
这种新系统完全以I型胶原蛋白打印,内径为1.4毫米,与普通乳房相匹配。该团队现已成功打印了超过25个生物打印模型。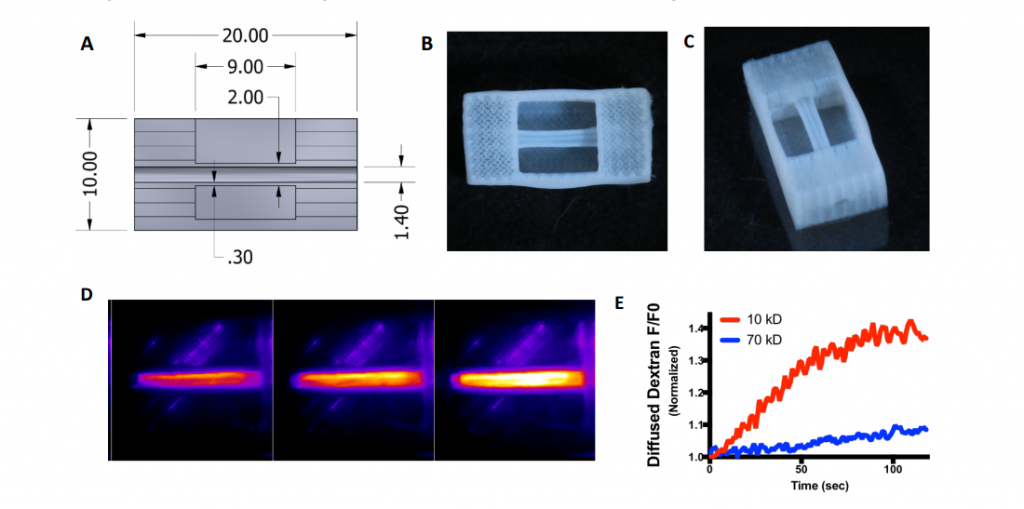
图4:重新设计的乳腺导管结构显示简化的管设计和灌注验证。(A)构造的示意图。(B和C)使用FRESH 3D生物打印方法完全由I型胶原打印的构建体的照片。(D)利用我们的生物反应器平台进行灌注研究,通过管腔注入不同分子量的荧光右旋糖酐,并跟踪通过管壁的扩散。(E)(D)中灌注和渗透性研究的量化,如预期的那样,显示通过壁的扩散取决于分子量,但也没有大的缺陷。
“在第1年,我们遇到了一些小的困难,例如某些小鼠品系的繁殖力降低,但我们在第2年继续这些研究并完成了如上所述的乳腺导管发育研究。在第2年,我们不得不改变3D导管微环境的设计,因为我们在第1年末开发的方法显示细胞的不均匀电镀和胶原蛋白的分层。我们重新设计了3D导管环境,以便更容易灌注和接种细胞。初步结果表明,当通过灌注去除毒素时,该模型具有更好的细胞铺板和细胞存活能力。在第3年(NCE),我们现在将研究这种微环境中细胞的生长。”研究人员总结道。
3D打印医疗模型在过去几年中产生了重大影响,特别是随着更多科学设施和医院开始在现场建立实验室。从使用它们作为指南,到重建像眼窝这样复杂的区域,再到培训医学生,甚至是生物打印脑肿瘤,以了解更多、模型、手术指南、植入物和设备,以及改变当今医学的面貌和全球患者的生活。













